Hao Qian, 37
Assistant de projet
Département de médecine cellulaire et moléculaire,
Université de Californie, San Diego
L’équipe de l’UCal veut développer un processus de création de nouveaux neurones (cellules) dans le cerveau des patients, réparer les circuits neuronaux endommagés et inverser les symptômes associés à la maladie de Parkinson. En d’autres termes, ils veulent guérir des patients Parkinson en remplaçant les cellules productrices de dopamine détruites par cette maladie.
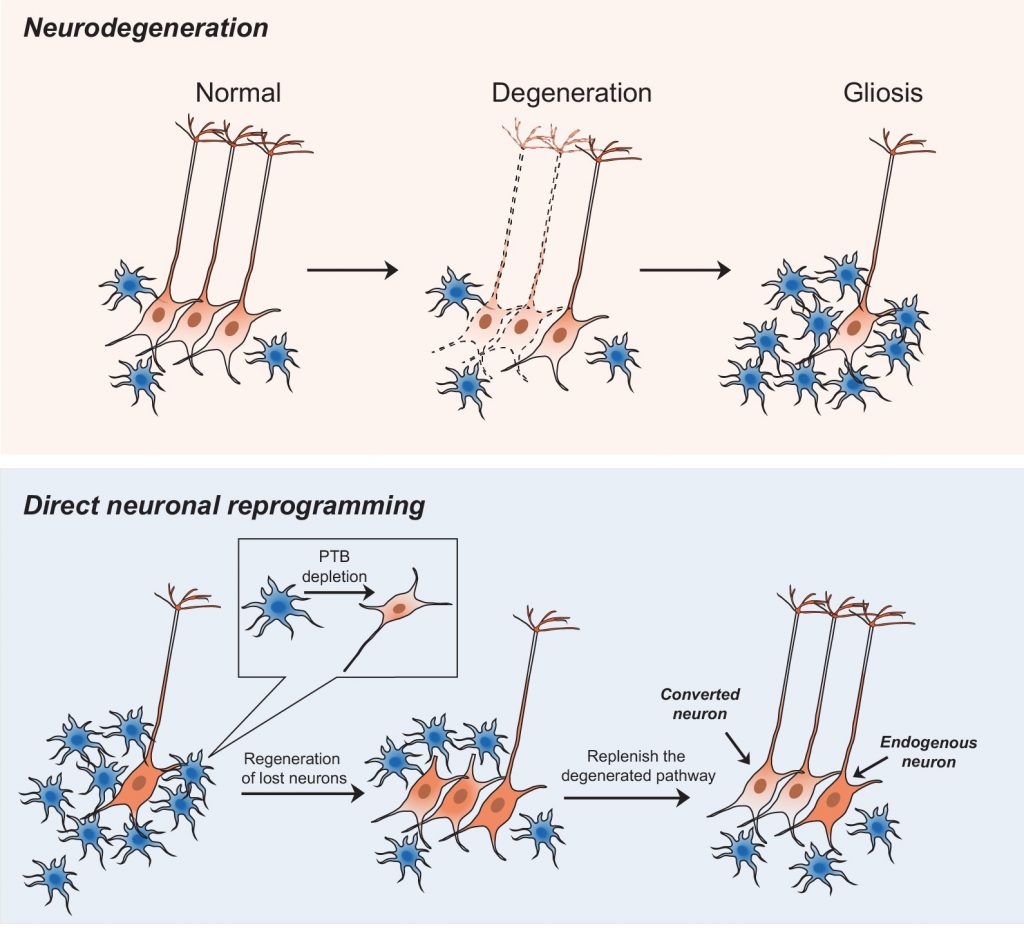
Jusqu’à présent, l’équipe a réussi à convertir des cellules non neuronales en neurones fonctionnels dans une section du cerveau de souris atteintes de la maladie de Parkinson. Ces nouveaux neurones sont parvenus à reconstruire la voie neuronale (système de communication entre les cellules) et à restaurer la fonction motrice de ces souris. En d’autres termes, suite à cette procédure, les souris parviennent de nouveau à contrôler leurs mouvements normalement.
Si vous souhaitez en savoir plus sur cette recherche, veuillez cliquer sur ce lien: https://www.nature.com/articles/d41586-020-01817-4
Pourquoi cette percée est-elle importante pour un futur traitement, voire la guérison, de la maladie de Parkinson ?
Jusqu’à présent, les approches thérapeutiques de la maladie de Parkinson se sont concentrées sur le traitement des symptômes moteurs par des médicaments ou la chirurgie. Elles n’ont pas réussi à reconstituer les neurones dopaminergiques perdus ou à modifier la façon dont la maladie évolue. De récents essais cliniques de thérapie cellulaire (pour d’autres affections) utilisant des cellules souches ont donné un nouvel espoir. Cependant, la thérapie par cellules souches présente de nombreux défis, notamment : un manque de sources de cellules fiables, un risque de formation de tumeurs et une réponse immunitaire potentiellement négative.
Dans notre projet de recherche, dont les résultats ont été récemment publiés dans la revue Nature, nous avons développé un moyen de convertir les astrocytes endogènes (un type de cellule abondante qui forme la structure du cerveau) en neurones dopaminergiques (cellules qui produisent l’hormone et le neurotransmetteur dopamine). Cela permet d’éviter les risques liés aux cellules souches. Ainsi, notre approche pourrait fournir une nouvelle méthode sûre pour régénérer les neurones dopaminergiques et réparer les circuits neuronaux endommagés dans le cerveau par la maladie de Parkinson.
Depuis combien de temps travaillez-vous sur ce projet et quelles en sont ou seront les suites ?
J’ai commencé à travailler sur ce projet en 2013. Au cours des prochaines années, je continuerai à travailler avec le professeur Xiang-dong Fu sur ce sujet à l’UCSD. Nous voulons surmonter plusieurs obstacles clés (détaillés dans la question 3) et tester notre approche sur des rats et des singes afin de recueillir davantage d’informations avant de passer à des essais cliniques sur l’homme.
Quelles sont les étapes nécessaires pour transposer votre découverte à des traitements, ou à une cure, disponibles pour les patients ? Combien de temps cela pourrait-il prendre ?
À ce jour, nos recherches se limitent aux souris. Pour mettre au point un traitement qui puisse être utilisé avec succès chez l’homme, nous devons encore aborder certaines questions essentielles. Plus important encore, nous ne savons pas si notre approche fonctionnera dans le cerveau humain. Nous avons constaté que notre méthode a entraîné une forte conversion neuronale chez les jeunes souris adultes – par contre, le degré de conversion était nettement moindre chez les animaux plus âgés. C’est un défi qu’il faut régler si nous voulons traiter les patients Parkinson, dont la majorité a plus de 60 ans.
En outre, notre approche repose sur la reconstruction de la voie nigrostriatale (le moyen par lequel la dopamine contrôle les mouvements) réalisée dans le cerveau des souris, mais nous n’avons aucune preuve que cela soit possible dans le cerveau humain. C’est un obstacle majeur à surmonter, surtout si l’on considère la différence de taille entre le cerveau d’une souris et le cerveau humain. Il faudra donc peut-être encore des années pour mettre au point une méthode thérapeutique cliniquement applicable à la maladie de Parkinson sur la base de nos recherches.
Combien vos recherches ont-elles coûté et comment ont-elles été financées ?
Ce projet a coûté plus de 500 000 dollars. Les ressources de financement comprenaient les National Institutes of Health et la Fondation Larry L. Hillblom.
Qu’est-ce qui vous motive à faire des recherches sur la maladie de Parkinson ?
Le but initial de nos recherches n’était pas de trouver un remède à la maladie de Parkinson. Notre intention initiale était d’en savoir plus sur la façon dont les différents neurones sont créés, c’est-à-dire sur les mécanismes moléculaires qui provoquent la formation de ces différents neurones. Mais lorsque nous avons réalisé que notre approche pouvait générer de nouveaux neurones dans le cerveau des mammifères, nous avons immédiatement pensé à la manière dont elle pourrait être utilisée pour traiter la maladie de Parkinson. De toutes les maladies neurodégénératives, la maladie de Parkinson est celle qui a le plus de chances d’être traitée par transplantation cellulaire, car ses symptômes sont causés par la dégénérescence d’une quantité relativement faible de neurones. Plusieurs autres rapports de recherche ont indiqué que les nouveaux neurones créés par un processus de greffe embryonnaire étaient capables de reconstruire la voie neuronale affectée et de restaurer la fonction motrice des rongeurs atteints de la maladie de Parkinson. Ces résultats nous ont encouragés à commencer nos expériences.
Avez-vous eu une expérience personnelle avec des patients atteints de la maladie de Parkinson et quel impact cela a-t-il eu sur vous ?
Le père d’un ami est atteint de la maladie de Parkinson. Quand il me l’a dit, j’ai réalisé que cette maladie est en fait très proche de nous et qu’elle peut détruire la vie de quelqu’un sans aucun avertissement.
Vos recherches pourraient-elles avoir des répercussions sur d’autres maladies également ?
Notre approche pourrait être appliquée pour traiter d’autres maladies dégénératives. Par exemple, il a été démontré que le même réactif crée de nouveaux photorécepteurs dans la rétine et rend la vue aux souris aveugles, ce qui laisse espérer la mise au point d’un traitement pour les maladies dégénératives de l’œil. Nous travaillons également avec nos collègues pour explorer comment notre approche pourrait être utilisée pour traiter la maladie d’Alzheimer et la maladie de Huntington.
Pourquoi pensez-vous qu’il est important de trouver un traitement pour la maladie de Parkinson ?
La maladie de Parkinson est l’une des maladies neurodégénératives liées à l’âge les plus courantes. On prévoit que le taux d’incidence de la maladie de Parkinson augmentera de manière significative avec l’allongement de la durée de vie. Les traitements actuels de la maladie de Parkinson ne parviennent pas à modifier l’évolution de la maladie ni à restaurer les fonctions perdues. Il est donc urgent de trouver un remède à la maladie de Parkinson pour protéger et sauver les patients et leurs familles.
Pensez-vous qu’un remède à la maladie de Parkinson soit possible dans les dix prochaines années ?
Bien que de nombreuses percées aient été signalées, je suis plus prudent quant à nos chances de trouver un « remède » à la maladie de Parkinson au cours de la prochaine décennie. Contrairement au cancer, les modèles animaux de maladies neurodégénératives ne sont pas un bon substitut pour l’homme. A titre d’exemple, dans le cas de la maladie d’Alzheimer, presque toutes les nouvelles stratégies thérapeutiques couronnées de succès chez les animaux ont échoué lors des essais cliniques chez l’homme, ce qui suggère que nous avons encore un long chemin à parcourir pour développer des traitements efficaces et sûrs pour les maladies neurodégénératives.
Que faut-il de plus pour que les scientifiques, comme vous, soient en mesure de faire les recherches nécessaires pour trouver un remède ?
Le soutien du public à la recherche sur la maladie de Parkinson et d’autres maladies neurodégénératives est crucial pour nous. Ce soutien incite les décideurs politiques à augmenter le budget de la science et à créer un meilleur environnement de recherche.
Quel est le dicton ou la devise qui vous inspire ?
« J’ai combattu le bon combat, j’ai achevé la course, j’ai gardé la foi. » (2 Timothée 4:7)